SITUACION 1 Y 2
1.- L a hormona insulina, involucrada en la regulación y metabolismo de la glucosa, fue hasta la década de los 80 obtenida de páncreas de cerdo o bovino para suministrarla a humanos con problemas en la producción de dicha hormona (Diabetes). Fue a partir de 1982, cuando se introdujo en el mercado insulina humana producida por una bacteria transgénica llamada Escherichia Coli. Acutualmente se emplean además de E. Coli, otros organismos, tales como algunos tipos de levaduras para obtener dicha hormona.
2.-La empresa Montesanto Comercial obtuvo las dos primeras autorizaciones de cultivo experimental de maíz transgénico en México-centro de origen del grano-, de parte de Sagarpa y Semarnat.
SITUACION 1:
Dentro de las situaciones mencionadas como el primer caso, esto puede ser posible dado a que el cerdo el día hoy es conocido por su similitud con el hombre, pueden usarse varias partes del organismo del cerdo en la medicina humana. Desde el suministro de sustancias vitales a la vida del hombre, hasta la donación de órganos, el cerdo es la gran opción de la medicina para aumentar la sobrevivencia de las personas. En el pasado, los Monos fueron considerados la gran opción en esta área, pero terminaron perdiendo su importancia, debido a su lenta capacidad de multiplicación y por la probabilidad de transmisión de enfermedades.
Sólo para tener una idea de la importancia que el cerdo puede asumir en la área de donación de órganos para el hombre, estadísticas en EE.UU. muestran que en el año 2000, había 67.000 pacientes esperando por los trasplantes en ese país (44.000 para Hígado, 4.000 para corazón y 3.600 para pulmones). Infelizmente, sólo 20 mil trasplantes fueron realizados. La investigación mostró que más de 100.000 personas, ni entraron en esta " línea de espera" y que miles se mueren todos los días por la falta de donadores.
Para lograr este tipo de xenotransplante (transplante de una especie hacia otra), son necesarias dos fases fundamentales: la producción de cerdos transgénicos y su posterior clonado. Cerdos transgénicos son cerdos que tuvieron su carga genética alterada, a través de la introducción de genes de otra especie animal, o del propio hombre. En la práctica, la técnica consiste en seleccionar un cierto gen humano que se quiere copiar, e introducirlo en el núcleo de un óvulo fecundado de cerdo. Con ello, el cerdo generado a partir de este óvulo alterado genéticamente, nacerá con un gen humano que producirá substancias compatibles con el hombre.
Los primeros cerdos transgénicos se produjeron en la década pasada: en 1991, científicos ingleses de la compañía Imutran, inyectaron ADN humano en un embrión del cerdo, y nace Astrid la primera cerda transgénica del mundo. En este mismo año, investigadores de la compañía DNX, de New Jersey, EE.UU., copian dos genes que controlan la producción de hemoglobina en el hombre y los inyectan en embriones de cerdos. Al nacer, los cerdos presentaron el 15% de sus hemoglobinas iguales a la del hombre. Éstas pudieron ser separadas de las hemoglobinas del cerdo, debido a sus cargas eléctricas diferentes, y pudieron usarse como una solución alternativa a la falta de sangre para transfusiones en el hombre.
La próxima fase después de la producción de cerdos transgénicos, es la técnica de la clonación, que consiste en realizar copias idénticas de un mismo individuo. De esa manera, podremos tener innumerables cerdos transgénicos, permitiendo la producción en gran cantidad de una cierta sustancia, remedios o incluso de órganos. Clonar es una técnica antigua, que ocurre naturalmente en el caso de gemelos idénticos y que ya era efectuada artificialmente en sapos, ratones y conejos. Últimamente, después de la famosa experiencia con la oveja Dolly, la técnica ganó un gran impulso y abrió una nueva era en la generación de varias copias de un mismo individuo.
http://www.produccion-animal.com.ar/produccion_porcina/95-humano.pdf http://www.llinas.net/esp/farma2.htm
SITUACION 2:
Dentro de la situación mencionada, ésta aprobación del cultivo experimental de maíz, ha tenido que ser necesario para incrementar la producción de alimentos en el mundo, inclusive a través de transgénicos, en México, la cuna del maíz, se ha desatado una polémica por el cultivo de variedades de este grano genéticamente modificadas.La manipulación genética del maíz, sagrado en la cosmogonía azteca al ser visto como el origen del hombre y base de la alimentación de los mexicanos, es un tema muy delicado en este país, donde se tienen registradas más de 50 especies endémicas del grano, incluidas roja y azul.
En días pasados, el Gobierno mexicano autorizó los 22 primeros permisos para que firmas como Monsanto, Dow AgroSciences y Pioneer realicen pruebas experimentales de maíz transgénico en granjas del norte y oeste de México.
Los críticos de los transgénicos temen que la amplia variedad de maíz mexicano se vea reducida a unos cuantos y resistentes granos genéticamente modificados, lo que además de amenazar las especies endémicas pondría en riesgo la subsistencia de cientos de miles de campesinos.
México es el primer productor mundial de maíz blanco, utilizado para elaborar las famosas tortillas, pero las importaciones de grano amarillo de Estados Unidos, destinado principalmente como alimento de ganado, se han multiplicado.
Las autorizaciones para el cultivo experimental de maíz transgénico son presentadas por el Gobierno como un esfuerzo para que México recupere su autosuficiencia alimentaria y así mantener los precios bajos.
http://www.google.com/hostednews/afp/article/ALeqM5i51I2Eicfd9N2ZrxmY0QMe8inOaA
SITUACION 6
LOS RIESGOS DEL TRASPLANTE DE GENES.
http://www.portalplanetasedna.com.ar/terapia.htm
www.medspain.com/ant/n1_oct98/genetica.htm
SITUACION 3
El programa del genoma humano sus metas a lograr
En los Estados Unidos está en marcha el programa del genoma humano, que financian y coordinan los National Institutes of Health y el departamento de Energia, el segundo porque realiza una evaluación permanente de los efectos sobre la salud humana de radiaciones y Sustancias quimicas relacionadas con la producción de energía; participan, además, la National Science Faundation, que apoya el desarrollo de la infraestructura, y el departamento de Agricultura, debido al creciente interés en conocer los genomas de plantas y animales. Los principales objetivos del proyecto genoma humano son:
- Determinar la localización relativa de los distintos genes humanos en los cromosomas (esto es, hacer un mapa genético) y establecer su estructura en términos de la secuencia de los pares de bases del ADN que los constituyen.
- Aplicar procedimientos similares a los genomas de otros organismos, para obtener la información comparativa que permita entender el funcionamiento de los genes humanos.
- Desarrollar y transferir las tecnologías necesarias para realizar lo anterior, incluyendo la recolección, acumulación, procesamiento y distribución de información experimental y el entrenamiento de investigadores en el tema.
- Estudiar los aspectos legales, sociales y éticos vinculados con el problema.
La primera secuencía completa del genoma humano no se realizará con material proveniente de un único individuo -se ha sugerido que una secuencia única no seria útil-, sino que resultará de integrar información de muchas fuentes, principalmente de células de origen humano que se mantienen en cultivo en diversos laboratorios. Por lo tanto, la secuencia será genérica y representará a los humanos en general; proveerá una referencia contra la cual comparar secuencias parciales de casos particulares (por ejemplo, personas con enfermedades hereditarias).
Se considera que el proyecto del genoma humano será de enorme importancia para la medicina del siglo XXI. Ayudará a diagnosticar, entender, prevenir y. eventualmente, tratar las más de 4000 enfermedades hereditarias humanas, y también aquellas de origenes múltiples pero en las que la predisposición hereditaria tiene un papel importante (entre las que se cuentan la diabetes, el cáncer y la hipertensión arterial). Los desarrollos tecnológicos necesarios para llevar a feliz término el proyecto se propagarán a otras ramas de las ciencias biológicas.
ALGO DE HISTORIA
En 1984, el biólogo molecular Robert Sinsheimer planteó la idea de fundar un Instituto para Secuenciar el Genoma Humano en la Universidad de California en Santa Cruz, de la que era rector.
En mayo de 1985, Sinsheimer convocó una reunión a la que acudió aproximadamente una docena de los mejores biólogos moleculares de EE.UU, para discutir la manera de llevarlo a cabo.
Finalmente, la idea de un Instituto del Genoma en Santa Cruz no se llevó a cabo, pero en su lugar empezó a cobrar impulso la idea de emprender algún esfuerzo coordinado para elaborar el mapa y descifrar las secuencias de los genes humanos. Uno de los más entusiastas fue el biólogo Renato Dulbecco, ganador del premio Nobel, que en otoño de 1985 defendió la secuenciación del genoma humano en un discurso pronunciado en el Laboratorio de Cold Spring Harbor, Nueva York, atrayendo la atención del director del laboratorio, James Watson.
El estudio de la Academia invirtió las prioridades del proyecto, resaltando los beneficios del atlas genético e insistiendo en la elaboración del mapa del genoma humano antes de empezar a descifrar la secuencia de pares de bases. Respaldaba los anteriores cálculos informales sobre el coste de la empresa, sugiriendo un presupuesto anual de 200 millones de dólares durante 15 años, e insistía en la importancia de estudiar los genomas de otros organismos, además del humano, para poder interpretar biológicamente los datos de este último. Por razones éticas evidentes, resulta imposible realizar experimentos de genética humana. A nadie se le ocurriría modificar deliberadamente un par de bases del ADN humano sólo para ver qué ocurre. Pero los experimentos genéticos con bacterias, por ejemplo, no plantean tantos problemas morales.
El comité del Consejo declaró lo siguiente: “Para obtener los mayores beneficios de una secuencia del genoma humano, será necesario disponer de una amplísima base de datos sobre las secuencias del ADN del ratón (cuyo genoma es del mismo tamaño que el humano) y de organismos más simples, con genomas mucho más pequeño, como las bacterias, las levaduras, la Drosophila melanogaster (una mosca de la fruta) y el Caenorhabditis elegans (un gusano nematodo)... Así pues, para que este proyecto tenga éxito, no debe limitarse al genoma humano, sino que debe incluir un análisis intensivo de secuencias de los genomas de otras especies escogidas...”
El 1 de octubre de 1988, Watson fue nombrado Director Asociado de la Investigación del Genoma Humano en los Institutos Nacionales de Salud, con un presupuesto de más de 28,2 millones de dólares para el período 1988-1989 (unos 10 millones más que el presupuesto del DOE para investigar el genoma el mismo año). Aquel mismo día, el NIH y el DOE firmaron un Memorándum de Entendimiento, en el que las dos agencias se comprometían a cooperar en la investigación del genoma. El Proyecto Genoma Humano de EE.UU. había emprendido la marcha, y con el NIH a la cabeza, en lugar del DOE.
El informe conjunto que salió de aquella reunión -Conocer nuestra herencia genética. El Proyecto Genoma Humano en EE.UU: los primeros cinco años- llegó al Congreso de la Nación en febrero de 1990. Representaba una puesta al día de los informes presentados dos años antes por el Consejo Nacional de Investigación y la Oficina de Supervisión de Tecnologías, y establecía objetivos concretos que la investigación debería cumplir para 1995. Desde luego, la secuenciación completa del genoma humano no se terminaría hasta más de medio siglo después de haber cartografiado la estructura del ADN
El primer objetivo fijado por la reunión de Cold Spring Harbor consistía en completar un mapa genético con marcadores situados a intervalos de 2 a 5 centimorgans.
El segundo objetivo consistió en elaborar un mapa puramente físico del genoma
Hacia 1998, un importante giro dio nuevo impulso a la investigación: computadoras poderosísimas fueron diseñadas e incorporadas a las tareas de desciframiento, trabajando 24 horas al día secuenciaban el material molecular, este paso hizo posible abreviar los tiempos.
Cuando en noviembre de 1999 se decodificó el cromosoma 22, se anunció la detección de 545 genes que estaban codificados en el cromosoma en cuestión y serían por lo menos 27 enfermedades las que están relacionadas con cambios en los genes del cromosoma 22 (v.gr., distintos tipos de cáncer, anomalías del desarrollo fetal o del sistema nervioso estarían vinculados, así como también la pérdida de una parte del cromosoma 22 sería la responsable de una frecuente enfermedad congénita del corazón, el síndrome de Di George, asociado a un déficit inmunitario y a una malformación del paladar y, probablemente, el gen involucrado con la esquizofrenia). Pero los expertos reconocieron que no estuvieron solos en su papel de descifradores de los "jeroglíficos" contenidos en el cromosoma, sino que contaron con la ayuda de máquinas robóticas que hicieron primero el trabajo a un nivel general, la bioinformática había logrado uno de sus éxitos.
SITUACION 6
La terapia génica pretende curar enfermedades hereditarias (que, en la mayoría de los casos, se deben a genes defectuosos) mediante la introducción de genes sanos. Es aplicable también al tratamiento de enfermedades actualmente incurables, como cánceres, determinadas patologías infecciosas (hepatitis, sida), cardiovasculares (hipercolesterolemia y aterosclerosis), enfermedades neurodegenerativas (enfermedades de Parkinson y de Alzheimer) o enfermedades crónicas (artritis reumatoide). Más de 5000 enfermedades humanas se han atribuido a factores genéticos.
La modificación del genoma de las células diana para que sinteticen una proteína de interés terapéutico permite compensar una insuficiencia debida a la alteración de un gen celular, estimular una mejor respuesta inmunitaria contra un tumor o conferir resistencia a la infección producida por un virus.
Concretamente, la terapia génica del cáncer se podría dirigir a:
* Fortalecer la protección natural del sistema inmunitario contra las células anormales incrementando el carácter extraño de estas células para estimular la acción del sistema inmunitario contra ellas.
* Envenenar los tumores introduciendo "genes suicidas" en células tumorales que transformen una sustancia no tóxica (por ejemplo, el aciclovir) en un veneno.
* Compensar el efecto cancerígeno de la mutación en un gen supresor de tumores (por ejemplo, el antioncogén p53) o bloquear la acción de un gen generador de tumores (oncogén). Para ello se deberían modificar todas las células tumorales. Además, la mayoría de los cánceres se producen por varias anomalías genéticas, lo que significa que la reversión de una sola, seguramente, no detendría la enfermedad. Este tratamiento sería importante en los casos de predisposición familiar hereditaria, en los que la mutación en un solo gen es fundamental.
Para que la terapia génica sea eficaz hay que resolver problemas relativos a la regulación de la expresión génica y a la fisiología del trasplante celular.
En terapia génica se utilizan dos grandes estrategias actualmente:
* Ex vivo. Consiste en extraer células de un paciente, modificarlas in vitro mediante un vector retrovírico y reimplantarlas en el organismo. El riesgo de rechazo es mínimo y, por ello, es la técnica más utilizada. Se usa fundamentalmente en el tratamiento de cánceres.
* In vivo. Se trata de administrar el gen corrector al paciente en lugar de hacerlo a células en cultivo. Se emplea en células difícil de extraer e implantar nuevamente, como sucede en la mucoviscidosis.
Las técnicas usadas se basan en la adición del gen sano, que puede permanecer fuera del cromosoma (episoma) o insertarse al azar en el genoma. En este caso, los genes insertados no se suelen expresar eficazmente y, además, pueden dañar a algún gen esencial. El proceso denominado sustitución dirigida de genes puede solucionar este problema. Se trata de introducir cambios específicos en la secuencia de nucleótidos de un gen. Así, es posible estudiar la intervención de los genes en los procesos biológicos. Identificar los genes y las mutaciones responsables de ciertas enfermedades permitirá conseguir las mismas mutaciones en ratones, para estudiar el mecanismo molecular de esas enfermedades y diseñar las terapias más eficaces.
LOS RIESGOS DEL TRASPLANTE DE GENES.
A medida que la ingeniería genética avanza surgen interrogantes sobre sus riesgos, tanto para la salud humana como para el funcionamiento de los ecosistemas. Por ello, existen reglamentaciones sobre las condiciones legales de utilización y diseminación de los organismos genéticamente modificados, en las que colaboran genetistas, bioéticos y juristas.
Es difícil estimar los riesgos y las consecuencias de la discrepancia entre el comportamiento efectivo del organismo genéticamente modificado y el comportamiento esperado.
La mayoría de los riesgos están relacionados con la producción y utilización de vectores para transmitir un gen extraño a una célula.
En cuanto a la producción de vectores, éstos suelen ser de origen vírico y, aunque se eligen atendiendo a su seguridad de empleo, es posible una recombinación genética entre el virus y las células de complementación, la cual puede originar partículas víricas replicativas capaces de infectar a otras células.
Respecto al uso terapéutico de vectores genéticamente modificados, cabe la posibilidad de que haya recombinación en el organismo humano. Si la célula blanco ya está infectada por un virus, una recombinación puede transformar el vector en virus infeccioso. Se eligen retrovirus que no tengan secuencias homólogas con los virus que infectan al hombre. Para evitar la diseminación de genes por virus, se limita el uso de vectores a determinados recintos.
Otro tipo de peligro se debe a la capacidad de los vectores retrovíricos de inducir la producción de tumores. Para evitarlo, se insertan en los vectores retrovíricos genes suicidas.
Pese a las precauciones los riesgos no se pueden eliminar totalmente. Habrá que idear procedimientos que garanticen la seguridad del enfermo y de su entorno. De este modo, podrá ser aceptada la terapia génica, con sus riesgos y con sus beneficios.
Otra clase de riesgos está relacionada con las modificaciones genéticamente de células germinales. Ya se han transformado células precursoras de espermatozoides en ratones; estas modificaciones se transmitirán a la descendencia. La tecnología abre diversas vías de investigación, como el estudio de la biología básica de la producción de espermatozoides, o el empleo de células precursoras de estos gametos en experimentos de ingeniería genética y terapia génica, ya que las alteraciones pasarían a las siguientes generaciones.
Las aplicaciones pueden ser beneficiosas, pero también problemáticas. Algunos expertos ya han señalado la diferencia que existe entre introducir genes nuevos para tratar una enfermedad y alterar el linaje de un individuo, lo cual puede crear graves desórdenes genéticos. Existe un debate sobre si los científicos deben, siquiera, intentar eliminar las enfermedades genética mediante terapias génicas de las células germinales.
Los peligros sobre los ecosistemas remiten a la posibilidad de diseminación del gen hacia otras especies y a las consecuencias de introducir organismos nuevos en un ecosistema, que siempre perturba los equilibrios ecológicos. Los movimientos ecologistas destacan que la propagación de un transgén por el ecosistema puede ir acompañada de efectos indeseables, como el caso del gen que codifica una toxina contra insectos parásitos de plantas, el cual puede favorecer el desarrollo de cepas de parásitos resistentes a esta toxina. Igualmente, se deberían evaluar los riesgos ligados a la diseminación de animales transgénicos, ya que es difícil evitar que escapen de los recintos de explotación, fundamentalmente, en los animales acuáticos y en los insectos, y que se crucen con los silvestres o que compitan con ellos.
El peligro que supone manejar microorganismos manipulados genéticamente depende de su capacidad para sobrevivir e intercambiar material genético con comunidades de microorganismos autóctonos. Su impacto en el medio ambiente es difícil de predecir; algunas especies podrían desplazarse o desaparecer, y las funciones y la estructura de las comunidades microbianas podría cambiar, alterando el funcionamiento del ecosistema.
A causa del insuficiente conocimiento de los efectos de la ingeniería genética, la legislación actual debería ser restrictiva y hacerse más permisiva a medida que avanzasen los conocimientos sobre el tema.
El desarrollo de la terapia genética se ha apoyado en los avances científicos experimentados por determinadas ramas de la biología, como la genética, la biología molecular, la virología o la bioquímica. El resultado es una técnica que permite la curación de casi cualquier patología de carácter genético.
En el desarrollo de dicha terapia hay que tener en cuenta diversos factores. Por un lado, es necesario saber cuál es "tejido diana", es decir, el que va a recibir la terapia. En segundo lugar, conocer si es posible tratar in situ el tejido afectado. Igualmente importante resulta determinar el que facilita el traspaso de un gen exógeno a la célula, es decir, qué vector se ha elegir para el desarrollo del nuevo material genético que posteriormente se introduce el tejido. Finalmente, es preciso estudiar al máximo la eficacia del gen nuevo y saber que respuesta tendrá el órgano o tejido «hospedador», con la entrada del gen modificado.
La finalidad principal de los estudios sobre terapia génica en el ámbito de la medicina es conseguir los mejores resultados tanto en prevención como en investigación, diagnóstico y terapia de las enfermedades hereditarias; sin embargo, esta manipulación del material genético puede ser utilizada en ingeniería genética, con el fin de mejorar determinadas características de los seres vivos.
Los inicios de la terapia génica
Los primeros trabajos en terapia génica se realizaron con ratones, mediante tecnica del ADN recombinante, que consiste en introducir el ADN extraño en los embriones, de forma que dicho ADN se expresa luego completamente, a medida que desarrolla el organismo. El material genético introducido se denomina transgén; los individuos a los que se les aplica esta técnica reciben el nombre de transgénicos. Con la introducción de estos transgenes se puede lograr la identificación de zonas concretas del material genético para llevar a cabo su cloonación, con el fin de que solo se vean afectadas un tipo específico de células.
Vectores
Los vectores virales agrupan cuatro tipos de virus: retrovírus, adenovirus, virus adnoasociados y herpesvirus; existen también vectores no virales, como el bombardeo con partículas, la inyección directa de ADN, los liposomas catiónicos y la transferencia de genes mediante receptores.
Vectores virales
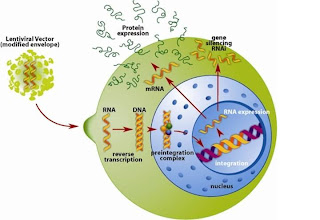
Los retrovirus comprenden una clase de virus cuyo material genético es una cadena sencilla de ARN; durante su ciclo vital, el virus se transcribe en una molécula bicatenaria de ADN, gracias a la acción de la enzima reverso transcriptasa, que se integra en el genoma de la célula huésped sin aparente daño para ella. La mayor parte de los retrovírus a excepción del HIV, sólo se pueden integrar en células con capacidad para replicarse, lo cual restringe su uso. Sin embargo, se pueden desarrollar en grandes cantidades y su expresión en la célula hospedadora se realiza durante largos periodos de tiempo. Los adenovirus son un conjunto de virus con ADN lineal de cadena doble. Los vectores de adenovirus son más grandes y complejos que los retrovirus, pues en su construcción solamente se elimina una pequeña región del material genético vírico. Su ciclo de infección, que comprende de 32 a 36 horas en un cultivo celular conlleva en primer lugar la síntesis de ADN de la célula y, posteriormente la sintesis y ensamblaje del ADN y las proteínas víricas. Las infecciones de estos virus en seres humanos están asociadas a enfermedades benignas, como la conjuntivitis.
La Principal ventaja de su utilización en la terapia génica es que se pueden producir en grandes cantidades y transfieren de forma muy eficaz el material genético a un número elevado de células y tejidos, aunque el hospedador parece limitar la duración de la expresión del nuevo material genético. Los virus adenoasociados son muy pequeño no autónomos y con ADN lineal de cadena sencilla. Para la replicación de estos virus es necesaria la confección con adenovirus. La inserción del material genetico de los adenovírus asociados se suele producir en regiones del cromosoma 19. Los vectores que se forman con este tipo de virus son muy simples, no pueden exceder en mucho la longitud del ADN viral, aproximadamente 4.680 nucleótidos, y son capaces de expresarse a largo plazo en las células que no se dividen; sin embargo, la respuesta que producen en la célula hospedadora es menor que la que se ocasiona con el tratamiento con adenovirus y es difícil la producción de este vector en grandes cantidades. Los herpesvirus poseen un material genético compuesto por ADN de doble cadena lineal, con un tamaño aproximado de 100 a 250 Kb.
Presentan variaciones en cuanto al tamaño y organización del genoma, contenido genético o células sobre las que actúan. Pero por regla general, este tipo de de virus son muy útiles, pues es posible insertar en su genoma grandes cantidades de ADN extraño y llevar a cabo durante largos periodos de tiempo infecciones latentes en la célula hospedadora, sin ningún efecto aparente sobre ésta. En la clase de los gamma-herpesvirus como el virus de Epstein-Barr, se pueden producir infecciones latentes en células en división, de modo que el material genético que lleva insertado el virus se replica conjuntamente a la división celular y se hereda en toda la nueva progenie de células. El inconveniente que presentan estos virus es que están asociados a daños linfoproliferativos, con lo cual, para su uso como vectores es necesario identificar estos genes y eliminarlos, manteniendo únicamente aquellos que permitan la replicación del virus y el mantenimiento del plásmido viral. Hasta la fecha, el uso fundamental de los herpesvirus en la terapia génica se limita al empleo in vivo del herpes simples (HSV)
Vectores no virales
El bombardeo de partículas constituye una técnica efectiva de transferir genes tanto in vitro como in vivo. En este método físico el plásmido o porción de ADN es recubierto en su superficie por gotas de oro o tungsteno, de 1 a 3 micras de diámetro. Estas partículas, aceleradas por una descarga eléctrica de un aparato o por un pulso de gas son «disparadas» hacia el tejido. El éxito de esta técnica puede estar asegurado en los procesos de vacunación. Otra alternativa es la inyección directa del ADN o ARN puro circular y cerrado covalentemente, dentro del tejido deseado. Este método económico, y un procedimiento no tóxico, si se compara con la entrega mediante virus. Como desventaja fundamental hay que señalar que los niveles y persistencia de la expresión de genes dura un corto periodo de tiempo. Esta tecnologia puede tener potencial como un procedimiento de vacunación y como e genes a un nivel bajo. Los liposomas catiónicos consisten en la mezcla de un 1 lipido catiónico de carga positiva y varias moléculas de ADN con carga negativa debido a los fosfatos de la doble hélice. Este tipo de vectores se han usado en el tratamiento de la fibrosis sistica y en las enfermedades vasculares. Se pueden realizar transferencias de estos vía catéter, aunque su uso es limitado, dedido a la baja eficacia de transfección del material genético contenido en este complejo a la célula hospedadora ya su relativa toxicidad. Un problema que se plantea con las técnicas anteriores es que el vector alcance realmente su objetivo y no quede diseminado por el organismo. Por ello existe un procedimiento que consiste en introducir, junto al material genético que queremos transferir, moléculas que puedan ser reconocidas por los receptores de la célula diana. Estas moléculas pueden ser azucares, péptidos, hormonas, etc. y su ventaja respecto a otros modelos es que se establece una interacción muy específica, como la interacción transportador/célula, y no muy inespecífica como la que se verifica entre las cargas iónicas.
www.medspain.com/ant/n1_oct98/genetica.htm
http://www.youtube.com/watch?v=3taJqAODG-w
SITUACION 7
SITUACION 7
Lo que nos plantea el estudio del genoma humano
La respuesta a esta pregunta requiere conocer cómo están hechos los genes y por que son diferentes unos de otros. Los genes son, segmentos de ADN. Es decir la famosa doble hélice esta estructura como de escalera de caracol, se mantiene unida por lo que vendrían siendo los escalones: enlace de timina con adenina y de guanina con citosina. En los distintos genes el orden en que se presentan estos enlaces varía y es en esta variación donde se funda la especialidad de cada gen.
El proyecto del genoma humano es en cierta medida la continuación posmoderna del mismo estudio. Se trata de construir el “mapa” del material genético, que nos permita saber para cada uno de los entre 50 mil y 100 mil genes del cuerpo humano cómo están hechos.
En octubre de 1990, el departamento de energía de los estados unidos lanzó formalmente el proyecto genoma humano para coordinar los esfuerzos transnacionales, de una veintena de países, para llevar a cabo esta titánica tarea de cartografía genética. Seremos capaces de identificar que enfermedad está asociada con que defecto de los genes. Podremos saber si tenemos la posibilidad de desarrollar un cáncer de piel o de colón o si un bebe será hemofílico, con un simple estudio del material genético contenido en nuestras células.
La llave del futuro
Para muchos conocedores, el más importante es el del logro de la posibilidad de localizar en el ADN cada uno de los cerca de 100 000 genes con que cuenta el ser humano, o en realidad, cualquier otra especie que se nos antoje. La información está codificada mediante 4 mil millones de “letras” bioquímicas distintas, constituidas por un número limitado de proteínas fundamentales.
Las mutaciones de algunos de esos genes los cuales a su vez constituyen, agrupados, cada uno de los cromosomas con que transmite de generación en generación toda la información genética, son la causa de terribles enfermedades hereditarias, y ahora se puede empezar a planear como contrarrestarlas, prevenirlas o curarlas.
Los bioquímicos contaban, ya para 1970, con técnicas de laboratorio para emplear ciertas enzimas con el fin de cortar, reproducir, transferir y soldar partes de la gran estructura del ADN. A partir de estas bases, y de las que proporciona la genética estadística, era posible desarrollar técnicas de laboratorio, capaces de señalar la parte de la enorme estructura del ADN relacionada con la enfermedad.
A principios de los ochenta, el esfuerzo empezó a dar frutos. Empleando una complicada técnica de laboratorio, desarrollada poco años antes, y conocida como la técnica RFLPs muy pronto popularizada como “reflips”e inventada por David Botsein , los expertos en genética molecular empezaron a determinar con exactitud el sitio en donde se encontraban los genes involucrados con la aparición de algunas enfermedades hereditarias, como la de Huntington, el de la distrofia muscular de Duchenne (DMD), el del retinoblastoma un cáncer ocular hereditario, el de cáncer de colon, el de la arteriosclerosis y el de la fibrosis quistica, cuyo descubridor fue el biólogo sino estadounidense Lap Chi Tsui.
Pero lo que queda en pie es sin duda el más grande de los retos que tiene planteados la ciencia: el logro del proyecto genoma humano, que permitiría diagnosticar y tratar las mas de 4 000 alteraciones genéticas de carácter hereditario que se conocen, y ello será posible aplicarlo ya muy pronto.
ACTIVIDAD 35
Respondiendo a las preguntas:
¿Permitir o no la manipulación genética?
R= La manipulación genética es prácticamente la alteración del ADN y del cual cierto organismo va a sufrir cambios, principalmente serán los animales. Para permitir la manipulación en mi punto de vista, primero hay que entender que los animales forman parte de nosotros y que su sufrimiento es el nuestro, hay que dejar de experimentar con ellos o de menos bajar el nivel de experimentos inadecuados a estos organismos. Para poder aplicarla primero haría que se hicieran otro tipo de experimentación más adecuada para que tanto humanos como animales tengamos la misma oportunidad de vivir, habría que buscar nuevas técnicas a nuestras necesidades, sin afectar a los demás.
Los organismos transgénicos de consumo humano son potencialmente dañinos para la salud SI-NO ¿Por qué?
Un organismo transgénicos es aquél que ha sufrido la alteración de su material hereditario (genoma) por la introducción artificial (manipulación genética) de un gene exógeno, esto es, proveniente de otro organismo completamente diferente. Los organismos transgénicos muestran que aparentemente no existen barreras para mezclar los genes (DNA) de dos especies diferentes. A mediados de los años sesenta se comenzaron a inventar bioherramientas moleculares con las cuales se podía componer y descomponer al DNA, lo que permitió intercambiar fragmentos específicos de la materia hereditaria de distintas especies e incluso transferirlos a microorganismos como las bacterias. Después se descubrió que esta práctica la venía haciendo la naturaleza desde hace millones de años con los vegetales a través de la bacteria llamada Agrobacterium tumefaciens.
Como se ve, durante las últimas 3 décadas, casi sin darnos cuenta, la humanidad ha dado el paso científico-tecnológico más importante desde la invención del fuego, ahora también domina el secreto de la vida y esta nueva revolución tecnológica ha abierto un fantástico abanico de posibilidades para influir sobre la vida en la Tierra, se plantean ahora muchas interrogantes de carácter ético y no sólo a la comunidad científica, sino a toda la humanidad, el gran debate del siglo XXI acaba de comenzar.
A pesar de ello, estos organismos para los humanos si son de cierto peligro, ya que en la mayoría de los humanos, al ser consumidos llegan a causar efectos secundarios que a la larga podrían empeorar, inclusive llevándolos hasta la muerte, pero ya sucedidos estos casos, los biocientíficos están buscando de encontrar nuevas alternativas, para reducir el índice de efectos secundarios y el índice de muertes a causa de la ingesta de dichos organismos transgénicos.
Pero también dentro de la industria de los transgénicos ha habido promesas incumplidas como; La industria de los transgénicos prometió que la soja RR sería un arma efectiva contra el hambre, pero lo cierto es que hoy la mayor parte de la cosecha se destina para aceites y harina de soja que sirven para la alimentación animal, y se concentra en mercados donde la prioridad es la baja de costos de insumos y no la auto-producción de alimentos sanos.
La industria también dijo que se utilizarían menos agroquímicos. Pero descubrimos que el herbicida estrella de la soja, el glifosato (su nombre comercial es Round Up), incrementó varias veces su volumen de aplicación. Y ante la aparición de malezas tolerantes al glifosato, ahora se lo combina con 2-4 D, un herbicida aún más tóxico
¿Permitir o no y en qué circunstancias la clonación?
R= Creo que el tema que si la clonación es buena o mala es más bien Social, Religioso o de la Naturaleza, pero ahi va mi comentario.
Medicamente o cientificamente no es malo porque que se trata de un avance que puede traer grandes beneficios a la humanidad como el que mencionas de poder obtener refacciones humanas de manera muy sencilla y de mucho mejor calidad que las donaciones.
El temor mundial a la clonación se deriva de una vaga ansiedad y una confusión acerca de una tecnología que parece fuera de control. Günther Stockinger escribió en la revista de noticias alemana Der Spiegel, en una crónica del año 1997:
Medicamente o cientificamente no es malo porque que se trata de un avance que puede traer grandes beneficios a la humanidad como el que mencionas de poder obtener refacciones humanas de manera muy sencilla y de mucho mejor calidad que las donaciones.
El temor mundial a la clonación se deriva de una vaga ansiedad y una confusión acerca de una tecnología que parece fuera de control. Günther Stockinger escribió en la revista de noticias alemana Der Spiegel, en una crónica del año 1997:
'Biólogos y doctores en cualquier parte del mundo podrían tener la idea de generar copias genéticamente idénticas de genios, súper atletas, artistas o estrellas de cine. La persona del estante, u "Homo xerox", ya no sería sólo ficción. Incluso Hitlers y Stalins podrían ser producidos en los laboratorios de bio-modeladores si solamente una célula de ellos que se pudiera usar fuera encontrada.'
Una de las razones principales para este temor en este mundo 'evolucionado' de hoy, es que no existe una línea divisoria entre el reino animal y los humanos, así que los mismos estándares éticos se aplican a ambos.
La Biblia, sin embargo, dibuja una línea clara entre los animales y los humanos, y nos da guías éticas:
Los humanos fueron creados separadamente, a la imagen de Dios, a diferencia del reino animal (Génesis 1:27). Nuestra existencia va más allá de la muerte física (Lucas 16:19-31, Filipenses 1:23). En ninguna parte se indica que es así para los animales.
Dios le permitió a los humanos matar animales (Génesis 9:2-3). Acerca de otros humanos, Él mandó: 'No matarás [el Hebreo ratsach significa 'asesinar']'(Éxodo 20:13).
Dios le encomendó a los humanos el dominio sobre el reino animal (Génesis 1:26). Pero a los humanos nunca se les dijo que tuvieran dominio sobre otros humanos, ni que los manipularan, como sería el caso de la clonación de humanos.
Aún más, los humanos deben tener madres y padres, y donde sea posible, ser el fruto de una relación sagrada de matrimonio, la familia ordenada por Dios. Mientras que en circunstancias desafortunadas en un mundo caído algunas veces los niños van a ser criados por un solo padre, un clon nunca podría tener dos padres. De esa manera la clonación artificial de un ser humano completo se opone a los principios bíblicos, porque deliberadamente da lugar a esa situación.
Por ultimo esta la naturaleza y el proceso natural de la vida, si modificamos drasticamente los patrones que modifican el tiempo promedio de vida del ser humano ya que al permitirse la clonacion todo el mundo deseara clonarse para no morir enonces la poblacion mundial creceria de una forma mas acelerada que lo que actualmente ya es un problema mundial y me refiro a la sobrepoblacion...
De esa manera, mientras está bien clonar animales bajo ciertas circunstancias, para el beneficio de las personas, pienso que es absolutamente incorrecto intentar clonar humanos.
¿Permitir o no y en que circunstancias la ingeniería genética?
R= En cuanto al tema de la Ingeniería Genética, podría aplicarse pero de manera muy controlada , ya que dado este punto entra lo que son los derechos tanto humanos como los derechos de los animales.
Como esta situación no está nada controlada, los biogenéticos hacen de los animales prácticamente una burla porque no hay valoración ni respeto a estos organismos, que son parte de nosotros y que gracias a ellos, la vida humana puede seguir.
La permitiría siempre y cuando haya un cierto limite para repartir animales a los científicos que harían estas experimentaciones.
¿Permitir o no y en que circunstancias la terapia génica?
R= La terapia génica esta diseñada para curar enfermedades hereditarias mediante la inserción de genes sanos. Esta terapia en la mayoría de las veces resulta ser muy efectiva, y muy poco resulta mal, sin embargo no veo porque no haya que prohibir dicha terapia; siempre y cuando no haya daños a terceros.
Para que la terapia génica sea eficaz hay que resolver problemas relativos a la regulación de la expresión génica y a la fisiología del trasplante celular.
En terapia génica se utilizan dos grandes estrategias actualmente:
* Ex vivo. Consiste en extraer células de un paciente, modificarlas in vitro mediante un vector retrovírico y reimplantarlas en el organismo. El riesgo de rechazo es mínimo y, por ello, es la técnica más utilizada. Se usa fundamentalmente en el tratamiento de cánceres.
* In vivo. Se trata de administrar el gen corrector al paciente en lugar de hacerlo a células en cultivo. Se emplea en células difícil de extraer e implantar nuevamente, como sucede en la mucoviscidosis.
Las técnicas usadas se basan en la adición del gen sano, que puede permanecer fuera del cromosoma (episoma) o insertarse al azar en el genoma. En este caso, los genes insertados no se suelen expresar eficazmente y, además, pueden dañar a algún gen esencial. El proceso denominado sustitución dirigida de genes puede solucionar este problema. Se trata de introducir cambios específicos en la secuencia de nucleótidos de un gen. Así, es posible estudiar la intervención de los genes en los procesos biológicos. Identificar los genes y las mutaciones responsables de ciertas enfermedades permitirá conseguir las mismas mutaciones en ratones, para estudiar el mecanismo molecular de esas enfermedades y diseñar las terapias más eficaces.